ໃນຂົງເຂດການແພດທີ່ທັນສະໄໝ, ຢາຕ້ານເຊື້ອໄດ້ພິສູດໃຫ້ເຫັນວ່າເປັນໜຶ່ງໃນຄວາມກ້າວໜ້າທີ່ສຳຄັນທີ່ສຸດ, ຫຼຸດຜ່ອນອັດຕາການເກີດ ແລະ ການຕາຍທີ່ກ່ຽວຂ້ອງກັບການຕິດເຊື້ອຈຸລິນຊີລົງຢ່າງຫຼວງຫຼາຍ. ຄວາມສາມາດຂອງຢາເຫຼົ່ານີ້ໃນການປ່ຽນແປງຜົນໄດ້ຮັບທາງດ້ານຄລີນິກຂອງການຕິດເຊື້ອແບັກທີເຣຍໄດ້ຍືດອາຍຸຍືນຂອງຄົນເຈັບນັບບໍ່ຖ້ວນ. ຢາຕ້ານເຊື້ອມີຄວາມສຳຄັນຫຼາຍໃນຂັ້ນຕອນການແພດທີ່ສັບສົນ, ລວມທັງການຜ່າຕັດ, ການຝັງຮາກ, ການປ່ຽນຖ່າຍ, ແລະ ການປິ່ນປົວດ້ວຍທາງເຄມີ. ຢ່າງໃດກໍຕາມ, ການເກີດຂຶ້ນຂອງເຊື້ອພະຍາດທີ່ຕ້ານທານຢາຕ້ານເຊື້ອໄດ້ເປັນຄວາມກັງວົນທີ່ເພີ່ມຂຶ້ນ, ເຮັດໃຫ້ປະສິດທິພາບຂອງຢາເຫຼົ່ານີ້ຫຼຸດລົງຕາມການເວລາ. ຕົວຢ່າງຂອງການຕ້ານທານຢາຕ້ານເຊື້ອໄດ້ຖືກບັນທຶກໄວ້ໃນທຸກປະເພດຂອງຢາຕ້ານເຊື້ອຍ້ອນວ່າການກາຍພັນຂອງຈຸລິນຊີເກີດຂຶ້ນ. ແຮງກົດດັນໃນການຄັດເລືອກທີ່ເກີດຈາກຢາຕ້ານເຊື້ອໄດ້ປະກອບສ່ວນເຂົ້າໃນການເພີ່ມຂຶ້ນຂອງເຊື້ອພັນທີ່ຕ້ານທານ, ເຊິ່ງເປັນສິ່ງທ້າທາຍທີ່ສຳຄັນຕໍ່ສຸຂະພາບຂອງໂລກ.
ເພື່ອຕ້ານກັບບັນຫາຮີບດ່ວນຂອງການດື້ຢາຕ້ານເຊື້ອ, ມັນເປັນສິ່ງຈຳເປັນທີ່ຈະຕ້ອງປະຕິບັດນະໂຍບາຍຄວບຄຸມການຕິດເຊື້ອທີ່ມີປະສິດທິພາບເພື່ອຫຼຸດຜ່ອນການແຜ່ລະບາດຂອງເຊື້ອພະຍາດທີ່ດື້ຢາ, ພ້ອມກັບການຫຼຸດຜ່ອນການໃຊ້ຢາຕ້ານເຊື້ອ. ນອກຈາກນັ້ນ, ຍັງມີຄວາມຕ້ອງການວິທີການປິ່ນປົວແບບອື່ນຢ່າງຮີບດ່ວນ. ການປິ່ນປົວດ້ວຍອົກຊີເຈນທີ່ມີຄວາມກົດດັນສູງ (HBOT) ໄດ້ກາຍເປັນວິທີການທີ່ມີຄວາມຫວັງໃນສະພາບການນີ້, ເຊິ່ງກ່ຽວຂ້ອງກັບການສູດດົມອົກຊີເຈນ 100% ໃນລະດັບຄວາມດັນສະເພາະເປັນໄລຍະເວລາໜຶ່ງ. HBOT ຖືວ່າເປັນການປິ່ນປົວຂັ້ນຕົ້ນ ຫຼື ການປິ່ນປົວແບບເສີມສຳລັບການຕິດເຊື້ອ, ໂດຍຖືກວາງໄວ້ເປັນການປິ່ນປົວແບບປະຖົມ ຫຼື ແບບເສີມສຳລັບການຕິດເຊື້ອ, ອາດຈະສະເໜີຄວາມຫວັງໃໝ່ໃນການປິ່ນປົວການຕິດເຊື້ອສ້ວຍແຫຼມທີ່ເກີດຈາກເຊື້ອພະຍາດທີ່ດື້ຢາຕ້ານເຊື້ອ.
ການປິ່ນປົວນີ້ໄດ້ຖືກນໍາໃຊ້ເພີ່ມຂຶ້ນເປັນການປິ່ນປົວຂັ້ນຕົ້ນ ຫຼື ທາງເລືອກສໍາລັບອາການຕ່າງໆ, ລວມທັງການອັກເສບ, ການເປັນພິດຈາກຄາບອນມໍນອກໄຊ, ບາດແຜຊໍາເຮື້ອ, ພະຍາດຂາດເລືອດ, ແລະ ການຕິດເຊື້ອ. ຄໍາຮ້ອງສະຫມັກທາງດ້ານຄລີນິກຂອງ HBOT ໃນການປິ່ນປົວການຕິດເຊື້ອແມ່ນເລິກເຊິ່ງ, ສະໜອງຜົນປະໂຫຍດທີ່ລ້ໍາຄ່າໃຫ້ແກ່ຄົນເຈັບ.

ການນໍາໃຊ້ທາງດ້ານຄລີນິກຂອງການປິ່ນປົວດ້ວຍອົກຊີເຈນທີ່ມີຄວາມໄວສູງໃນການຕິດເຊື້ອ
ຫຼັກຖານໃນປະຈຸບັນສະໜັບສະໜູນຢ່າງໜັກແໜ້ນເຖິງການນຳໃຊ້ HBOT, ທັງເປັນການປິ່ນປົວແບບດ່ຽວ ແລະ ການປິ່ນປົວແບບເສີມ, ເຊິ່ງນຳສະເໜີຜົນປະໂຫຍດທີ່ສຳຄັນຕໍ່ຄົນເຈັບທີ່ຕິດເຊື້ອ. ໃນລະຫວ່າງ HBOT, ຄວາມດັນອົກຊີເຈນໃນເລືອດສາມາດເພີ່ມຂຶ້ນເປັນ 2000 mmHg, ແລະ ການປ່ຽນແປງຄວາມດັນອົກຊີເຈນ-ເນື້ອເຍື່ອທີ່ສູງສາມາດຍົກລະດັບອົກຊີເຈນໃນເນື້ອເຍື່ອເປັນ 500 mmHg. ຜົນກະທົບດັ່ງກ່າວແມ່ນມີຄຸນຄ່າໂດຍສະເພາະໃນການສົ່ງເສີມການຮັກສາການຕອບສະໜອງຕໍ່ການອັກເສບ ແລະ ການລົບກວນຂອງຈຸລະພາກທີ່ສັງເກດເຫັນໃນສະພາບແວດລ້ອມຂອງພະຍາດຂາດເລືອດ, ເຊັ່ນດຽວກັນກັບໃນການຄຸ້ມຄອງໂຣກ compartment syndrome.
HBOT ຍັງສາມາດສົ່ງຜົນກະທົບຕໍ່ສະພາບການທີ່ຂຶ້ນກັບລະບົບພູມຕ້ານທານ. ການຄົ້ນຄວ້າຊີ້ໃຫ້ເຫັນວ່າ HBOT ສາມາດສະກັດກັ້ນໂຣກພູມຕ້ານທານຕົນເອງ ແລະ ການຕອບສະໜອງຂອງພູມຕ້ານທານທີ່ເກີດຈາກແອນຕິເຈນ, ຊ່ວຍຮັກສາຄວາມທົນທານຕໍ່ການຕໍ່ເນື່ອງໂດຍການຫຼຸດຜ່ອນການໄຫຼວຽນຂອງຈຸລັງລິມໂຟໄຊຕ໌ ແລະ ຈຸລັງເມັດເລືອດຂາວ ໃນຂະນະທີ່ປັບການຕອບສະໜອງຂອງພູມຕ້ານທານ. ນອກຈາກນັ້ນ, HBOTສະໜັບສະໜູນການປິ່ນປົວໃນບາດແຜຜິວໜັງຊຳເຮື້ອໂດຍການກະຕຸ້ນການສ້າງເສັ້ນເລືອດໃໝ່, ເຊິ່ງເປັນຂະບວນການທີ່ສຳຄັນສຳລັບການຟື້ນຟູທີ່ດີຂຶ້ນ. ການປິ່ນປົວນີ້ຍັງຊ່ວຍກະຕຸ້ນການສ້າງ collagen matrix, ເຊິ່ງເປັນໄລຍະທີ່ສຳຄັນໃນການຮັກສາບາດແຜ.
ຕ້ອງເອົາໃຈໃສ່ເປັນພິເສດຕໍ່ການຕິດເຊື້ອບາງຊະນິດ, ໂດຍສະເພາະການຕິດເຊື້ອທີ່ເລິກ ແລະ ຍາກທີ່ຈະປິ່ນປົວເຊັ່ນ: ພະຍາດເຍື່ອຫຸ້ມເຊລອັກເສບ, ພະຍາດກະດູກອັກເສບ, ການຕິດເຊື້ອເນື້ອເຍື່ອອ່ອນຊໍາເຮື້ອ, ແລະ ພະຍາດເຍື່ອຫຸ້ມຫົວໃຈອັກເສບ. ໜຶ່ງໃນການນຳໃຊ້ທາງຄລີນິກທີ່ພົບເລື້ອຍທີ່ສຸດຂອງ HBOT ແມ່ນສຳລັບການຕິດເຊື້ອຜິວໜັງ-ເນື້ອເຍື່ອອ່ອນ ແລະ ພະຍາດກະດູກອັກເສບທີ່ກ່ຽວຂ້ອງກັບລະດັບອົກຊີເຈນຕໍ່າ ເຊິ່ງມັກຈະເກີດຈາກເຊື້ອແບັກທີເຣຍທີ່ບໍ່ມີອົກຊີເຈນ ຫຼື ເຊື້ອແບັກທີເຣຍທີ່ຕ້ານທານ.
1. ການຕິດເຊື້ອຕີນຂອງຜູ້ເປັນໂລກເບົາຫວານ
ຕີນສຳລັບຜູ້ເປັນເບົາຫວານແຜໃນຕີນເປັນອາການແຊກຊ້ອນທີ່ພົບເລື້ອຍໃນບັນດາຄົນເຈັບທີ່ເປັນໂລກເບົາຫວານ, ເຊິ່ງມີຜົນກະທົບຕໍ່ປະຊາກອນເຖິງ 25%. ການຕິດເຊື້ອມັກເກີດຂຶ້ນໃນແຜເຫຼົ່ານີ້ (ກວມເອົາ 40%-80% ຂອງກໍລະນີ) ແລະ ນຳໄປສູ່ການເພີ່ມຂຶ້ນຂອງການເຈັບເປັນ ແລະ ອັດຕາການຕາຍ. ການຕິດເຊື້ອຕີນເບົາຫວານ (DFIs) ມັກຈະປະກອບດ້ວຍການຕິດເຊື້ອຫຼາຍຊະນິດທີ່ມີເຊື້ອແບັກທີເຣຍທີ່ບໍ່ມີອົກຊີເຈນຫຼາຍຊະນິດທີ່ພົບ. ມີຫຼາຍປັດໃຈ, ລວມທັງຄວາມຜິດປົກກະຕິຂອງການເຮັດວຽກຂອງ fibroblast, ບັນຫາການສ້າງ collagen, ກົນໄກພູມຕ້ານທານຂອງຈຸລັງ, ແລະ ການເຮັດວຽກຂອງ phagocyte, ສາມາດຂັດຂວາງການຫາຍດີຂອງບາດແຜໃນຄົນເຈັບທີ່ເປັນໂລກເບົາຫວານ. ການສຶກສາຫຼາຍໆຄັ້ງໄດ້ລະບຸວ່າການຂາດອົກຊີເຈນໃນຜິວໜັງເປັນປັດໄຈສ່ຽງທີ່ເຂັ້ມແຂງສຳລັບການຕັດແຂນຂາທີ່ກ່ຽວຂ້ອງກັບ DFIs.
ໃນຖານະເປັນໜຶ່ງໃນທາງເລືອກໃນປະຈຸບັນສຳລັບການປິ່ນປົວ DFI, HBOT ໄດ້ຖືກລາຍງານວ່າຊ່ວຍເພີ່ມອັດຕາການຮັກສາບາດແຜຕີນຂອງຜູ້ເປັນໂລກເບົາຫວານໄດ້ຢ່າງຫຼວງຫຼາຍ, ເຊິ່ງຊ່ວຍຫຼຸດຜ່ອນຄວາມຕ້ອງການໃນການຕັດແຂນຂາ ແລະ ການຜ່າຕັດທີ່ສັບສົນ. ມັນບໍ່ພຽງແຕ່ຫຼຸດຜ່ອນຄວາມຈຳເປັນສຳລັບຂັ້ນຕອນທີ່ໃຊ້ຊັບພະຍາກອນຫຼາຍ, ເຊັ່ນ: ການຜ່າຕັດແຜ່ນໜັງ ແລະ ການປູກຜິວໜັງ, ແຕ່ຍັງມີຄ່າໃຊ້ຈ່າຍຕ່ຳກວ່າ ແລະ ມີຜົນຂ້າງຄຽງໜ້ອຍທີ່ສຸດເມື່ອທຽບກັບການຜ່າຕັດ. ການສຶກສາໂດຍ Chen ແລະ ເພື່ອນຮ່ວມງານໄດ້ສະແດງໃຫ້ເຫັນວ່າ HBOT ຫຼາຍກວ່າ 10 ຄັ້ງນຳໄປສູ່ການປັບປຸງອັດຕາການຮັກສາບາດແຜໃນຄົນເຈັບທີ່ເປັນໂລກເບົາຫວານ 78.3%.
2. ການຕິດເຊື້ອເນື້ອເຍື່ອອ່ອນເນົ່າເປື່ອຍ
ການຕິດເຊື້ອເນື້ອເຍື່ອອ່ອນເນົ່າເປື່ອຍ (NSTIs) ມັກຈະເປັນພະຍາດຫຼາຍຊະນິດ, ໂດຍປົກກະຕິແລ້ວເກີດຈາກການລວມກັນຂອງເຊື້ອພະຍາດແບັກທີເຣຍທີ່ມີທັງແບບແອໂຣບິກ ແລະ ແບບບໍ່ມີອົກຊີເຈນ ແລະ ມັກຈະກ່ຽວຂ້ອງກັບການຜະລິດອາຍແກັສ. ໃນຂະນະທີ່ NSTIs ແມ່ນຫາຍາກ, ແຕ່ພວກມັນມີອັດຕາການຕາຍສູງເນື່ອງຈາກຄວາມຄືບໜ້າຢ່າງໄວວາ. ການວິນິດໄສ ແລະ ການປິ່ນປົວທີ່ທັນເວລາ ແລະ ເໝາະສົມແມ່ນກຸນແຈສຳຄັນໃນການບັນລຸຜົນໄດ້ຮັບທີ່ເອື້ອອຳນວຍ, ແລະ HBOT ໄດ້ຖືກແນະນຳໃຫ້ເປັນວິທີການເສີມໃນການຈັດການ NSTIs. ເຖິງແມ່ນວ່າຍັງມີການໂຕ້ຖຽງກັນກ່ຽວກັບການນຳໃຊ້ HBOT ໃນ NSTIs ເນື່ອງຈາກການຂາດການສຶກສາທີ່ຄວບຄຸມແບບມີທ່າແຮງ,ຫຼັກຖານຊີ້ໃຫ້ເຫັນວ່າມັນອາດຈະກ່ຽວຂ້ອງກັບອັດຕາການຢູ່ລອດທີ່ດີຂຶ້ນ ແລະ ການຮັກສາອະໄວຍະວະໃນຄົນເຈັບ NSTIການສຶກສາຍ້ອນຫຼັງໄດ້ຊີ້ບອກເຖິງການຫຼຸດລົງຢ່າງຫຼວງຫຼາຍຂອງອັດຕາການຕາຍໃນບັນດາຄົນເຈັບ NSTI ທີ່ໄດ້ຮັບ HBOT.
1.3 ການຕິດເຊື້ອບໍລິເວນຜ່າຕັດ
ການຕິດເຊື້ອທີ່ບໍ່ສາມາດຄວບຄຸມໄດ້ (SSIs) ສາມາດຈັດປະເພດໄດ້ໂດຍອີງໃສ່ບໍລິເວນທາງກາຍວິພາກຂອງການຕິດເຊື້ອ ແລະ ສາມາດເກີດຂື້ນຈາກເຊື້ອພະຍາດຕ່າງໆ, ລວມທັງເຊື້ອແບັກທີເຣັຍທີ່ມີທັງແບບແອໂຣບິກ ແລະ ແບບບໍ່ມີອົກຊີເຈນ. ເຖິງວ່າຈະມີຄວາມກ້າວໜ້າໃນມາດຕະການຄວບຄຸມການຕິດເຊື້ອ, ເຊັ່ນ: ເຕັກນິກການຂ້າເຊື້ອ, ການໃຊ້ຢາຕ້ານເຊື້ອເພື່ອປ້ອງກັນ, ແລະ ການປັບປຸງໃນການຜ່າຕັດ, ການຕິດເຊື້ອທີ່ບໍ່ສາມາດຄວບຄຸມໄດ້ຍັງຄົງເປັນອາການແຊກຊ້ອນທີ່ຍັງຄົງຄ້າງ.
ການທົບທວນທີ່ສຳຄັນອັນໜຶ່ງໄດ້ສືບສວນປະສິດທິພາບຂອງ HBOT ໃນການປ້ອງກັນ SSIs ທີ່ເລິກໃນການຜ່າຕັດກະດູກສັນຫຼັງກະດູກສັນຫຼັງ. HBOT ກ່ອນການຜ່າຕັດອາດຈະຊ່ວຍຫຼຸດຜ່ອນອັດຕາການເກີດຂອງ SSIs ແລະຊ່ວຍໃຫ້ບາດແຜຫາຍດີໄດ້ຢ່າງຫຼວງຫຼາຍ. ການປິ່ນປົວແບບບໍ່ຮຸກຮານນີ້ສ້າງສະພາບແວດລ້ອມທີ່ລະດັບອົກຊີເຈນໃນເນື້ອເຍື່ອບາດແຜສູງຂຶ້ນ, ເຊິ່ງກ່ຽວຂ້ອງກັບການຂ້າເຊື້ອພະຍາດ. ນອກຈາກນັ້ນ, ມັນຍັງແກ້ໄຂບັນຫາລະດັບເລືອດ ແລະ ອົກຊີເຈນທີ່ຫຼຸດລົງເຊິ່ງປະກອບສ່ວນເຂົ້າໃນການພັດທະນາ SSIs. ນອກເໜືອໄປຈາກຍຸດທະສາດການຄວບຄຸມການຕິດເຊື້ອອື່ນໆ, HBOT ໄດ້ຖືກແນະນຳໂດຍສະເພາະສຳລັບການຜ່າຕັດທີ່ສະອາດ ແລະ ປົນເປື້ອນເຊັ່ນ: ຂັ້ນຕອນການຜ່າຕັດລຳໄສ້ໃຫຍ່ ແລະ ທວານໜັກ.
1.4 ບາດແຜ
ບາດແຜໄໝ້ແມ່ນການບາດເຈັບທີ່ເກີດຈາກຄວາມຮ້ອນທີ່ຮຸນແຮງ, ກະແສໄຟຟ້າ, ສານເຄມີ, ຫຼື ລັງສີ ແລະ ສາມາດສ້າງອັດຕາການເຈັບເປັນ ແລະ ການຕາຍສູງ. HBOT ມີປະໂຫຍດໃນການປິ່ນປົວບາດແຜໄໝ້ໂດຍການເພີ່ມລະດັບອົກຊີເຈນໃນເນື້ອເຍື່ອທີ່ເສຍຫາຍ. ໃນຂະນະທີ່ການສຶກສາໃນສັດ ແລະ ການສຶກສາທາງດ້ານຄລີນິກນຳສະເໜີຜົນໄດ້ຮັບທີ່ປະສົມປະສານກ່ຽວກັບປະສິດທິພາບຂອງ HBOT ໃນການປິ່ນປົວບາດແຜໄໝ້ການສຶກສາທີ່ກ່ຽວຂ້ອງກັບຄົນເຈັບທີ່ຖືກໄຟໄໝ້ 125 ຄົນຊີ້ໃຫ້ເຫັນວ່າ HBOT ບໍ່ມີຜົນກະທົບທີ່ສຳຄັນຕໍ່ອັດຕາການຕາຍ ຫຼື ຈຳນວນການຜ່າຕັດທີ່ເຮັດ, ແຕ່ໄດ້ຫຼຸດເວລາການຫາຍດີໂດຍສະເລ່ຍ (19.7 ມື້ ທຽບກັບ 43.8 ມື້). ການປະສົມປະສານ HBOT ກັບການຄຸ້ມຄອງການຫາຍດີຢ່າງຄົບຖ້ວນສາມາດຄວບຄຸມການຕິດເຊື້ອໃນຄົນເຈັບທີ່ຖືກໄຟໄໝ້ໄດ້ຢ່າງມີປະສິດທິພາບ, ເຊິ່ງນຳໄປສູ່ເວລາການຫາຍດີສັ້ນລົງ ແລະ ຄວາມຕ້ອງການນ້ຳຫຼຸດລົງ. ຢ່າງໃດກໍຕາມ, ຕ້ອງມີການຄົ້ນຄວ້າທີ່ກວ້າງຂວາງຕື່ມອີກເພື່ອຢືນຢັນບົດບາດຂອງ HBOT ໃນການຄຸ້ມຄອງການຫາຍດີຢ່າງກວ້າງຂວາງ.
1.5 ໂຣກກະດູກອັກເສບ
ພະຍາດກະດູກອັກເສບ ແມ່ນການຕິດເຊື້ອຂອງກະດູກ ຫຼື ໄຂກະດູກ ເຊິ່ງມັກເກີດຈາກເຊື້ອແບັກທີເຣຍ. ການປິ່ນປົວພະຍາດກະດູກອັກເສບອາດຈະເປັນສິ່ງທ້າທາຍ ເນື່ອງຈາກການສະໜອງເລືອດໄປຫາກະດູກບໍ່ດີ ແລະ ການຊຶມເຂົ້າຂອງຢາຕ້ານເຊື້ອເຂົ້າໄປໃນໄຂກະດູກມີຈຳກັດ. ພະຍາດກະດູກອັກເສບຊຳເຮື້ອມີລັກສະນະໂດຍເຊື້ອພະຍາດທີ່ຍັງຄົງຢູ່, ການອັກເສບເບົາບາງ, ແລະ ການສ້າງເນື້ອເຍື່ອກະດູກທີ່ເນົ່າເປື່ອຍ. ພະຍາດກະດູກອັກເສບທີ່ທົນຕໍ່ການປິ່ນປົວ ໝາຍເຖິງການຕິດເຊື້ອກະດູກຊຳເຮື້ອທີ່ສືບຕໍ່ ຫຼື ເກີດຂຶ້ນອີກ ເຖິງວ່າຈະມີການປິ່ນປົວທີ່ເໝາະສົມກໍຕາມ.
HBOT ໄດ້ສະແດງໃຫ້ເຫັນວ່າສາມາດປັບປຸງລະດັບອົກຊີເຈນໃນເນື້ອເຍື່ອກະດູກທີ່ຕິດເຊື້ອໄດ້ຢ່າງຫຼວງຫຼາຍ. ການສຶກສາຊຸດກໍລະນີ ແລະ ກຸ່ມຄົນຈຳນວນຫຼາຍຊີ້ໃຫ້ເຫັນວ່າ HBOT ຊ່ວຍເສີມສ້າງຜົນໄດ້ຮັບທາງດ້ານຄລີນິກສຳລັບຄົນເຈັບທີ່ເປັນໂລກກະດູກອັກເສບ. ມັນເບິ່ງຄືວ່າເຮັດວຽກຜ່ານກົນໄກຕ່າງໆ, ລວມທັງການເພີ່ມກິດຈະກຳການເຜົາຜານອາຫານ, ການສະກັດກັ້ນເຊື້ອແບັກທີເຣຍ, ການເພີ່ມຜົນກະທົບຂອງຢາຕ້ານເຊື້ອ, ການຫຼຸດຜ່ອນການອັກເສບ, ແລະ ການສົ່ງເສີມການຮັກສາ.ຂະບວນການຕ່າງໆ. ຫຼັງການຜ່າຕັດດ້ວຍວິທີ HBOT, 60% ຫາ 85% ຂອງຄົນເຈັບທີ່ເປັນໂຣກກະດູກອັກເສບຊໍາເຮື້ອ ແລະ ທົນທານຕໍ່ການປິ່ນປົວສະແດງໃຫ້ເຫັນອາການຂອງການສະກັດກັ້ນການຕິດເຊື້ອ.
1.6 ການຕິດເຊື້ອລາ
ໃນທົ່ວໂລກ, ມີບຸກຄົນຫຼາຍກວ່າສາມລ້ານຄົນທີ່ທຸກທໍລະມານຈາກການຕິດເຊື້ອລາຊໍາເຮື້ອ ຫຼື ການຕິດເຊື້ອລາທີ່ຮຸກຮານ, ເຊິ່ງນໍາໄປສູ່ການເສຍຊີວິດຫຼາຍກວ່າ 600,000 ຄົນຕໍ່ປີ. ຜົນໄດ້ຮັບການປິ່ນປົວສໍາລັບການຕິດເຊື້ອລາມັກຈະໄດ້ຮັບຜົນກະທົບຍ້ອນປັດໃຈຕ່າງໆເຊັ່ນ: ສະຖານະພາບພູມຕ້ານທານທີ່ປ່ຽນແປງ, ພະຍາດພື້ນຖານ, ແລະລັກສະນະຄວາມຮຸນແຮງຂອງເຊື້ອພະຍາດ. HBOT ກໍາລັງກາຍເປັນທາງເລືອກໃນການປິ່ນປົວທີ່ໜ້າສົນໃຈໃນການຕິດເຊື້ອລາຮຸນແຮງເນື່ອງຈາກຄວາມປອດໄພ ແລະ ລັກສະນະທີ່ບໍ່ຮຸກຮານ. ການສຶກສາຊີ້ໃຫ້ເຫັນວ່າ HBOT ອາດຈະມີປະສິດທິພາບຕໍ່ກັບເຊື້ອລາເຊັ່ນ: Aspergillus ແລະ Mycobacterium tuberculosis.
HBOT ສົ່ງເສີມຜົນກະທົບຂອງຢາຕ້ານເຊື້ອລາໂດຍການຍັບຍັ້ງການສ້າງ biofilm ຂອງ Aspergillus, ໂດຍມີປະສິດທິພາບເພີ່ມຂຶ້ນທີ່ສັງເກດເຫັນໃນເຊື້ອທີ່ຂາດ gene superoxide dismutase (SOD). ສະພາບການຂາດອົກຊີເຈນໃນລະຫວ່າງການຕິດເຊື້ອຂອງເຊື້ອລາສ້າງຄວາມທ້າທາຍຕໍ່ການຈັດສົ່ງຢາຕ້ານເຊື້ອລາ, ເຮັດໃຫ້ລະດັບອົກຊີເຈນທີ່ເພີ່ມຂຶ້ນຈາກ HBOT ເປັນການແຊກແຊງທີ່ເປັນປະໂຫຍດ, ເຖິງແມ່ນວ່າການຄົ້ນຄວ້າຕື່ມອີກແມ່ນມີຄວາມຈຳເປັນ.
ຄຸນສົມບັດຕ້ານເຊື້ອຈຸລິນຊີຂອງ HBOT
ສະພາບແວດລ້ອມທີ່ມີອົກຊີເຈນສູງທີ່ເກີດຈາກ HBOT ເຮັດໃຫ້ເກີດການປ່ຽນແປງທາງສະລີລະວິທະຍາ ແລະ ຊີວະເຄມີທີ່ກະຕຸ້ນຄຸນສົມບັດຕ້ານເຊື້ອແບັກທີເຣຍ, ເຮັດໃຫ້ມັນເປັນການປິ່ນປົວເສີມທີ່ມີປະສິດທິພາບສຳລັບການຕິດເຊື້ອ. HBOT ສະແດງໃຫ້ເຫັນຜົນກະທົບທີ່ໂດດເດັ່ນຕໍ່ກັບເຊື້ອແບັກທີເຣຍແອໂຣບິກ ແລະ ເຊື້ອແບັກທີເຣຍທີ່ບໍ່ມີອົກຊີເຈນສ່ວນໃຫຍ່ແມ່ນຜ່ານກົນໄກຕ່າງໆເຊັ່ນ: ກິດຈະກຳການຂ້າເຊື້ອແບັກທີເຣຍໂດຍກົງ, ການເພີ່ມການຕອບສະໜອງຂອງພູມຕ້ານທານ, ແລະ ຜົນກະທົບຮ່ວມກັນກັບຕົວແທນຕ້ານເຊື້ອຈຸລິນຊີສະເພາະ.
2.1 ຜົນກະທົບໂດຍກົງຕໍ່ເຊື້ອແບັກທີເຣຍຂອງ HBOT
ຜົນກະທົບທາງຕ້ານເຊື້ອແບັກທີເຣັຍໂດຍກົງຂອງ HBOT ສ່ວນໃຫຍ່ແມ່ນຍ້ອນການສ້າງຊະນິດອົກຊີເຈນທີ່ມີປະຕິກິລິຍາ (ROS), ເຊິ່ງປະກອບມີອະນຸມູນອິສະລະ superoxide, hydrogen peroxide, hydroxyl radicals, ແລະ hydroxyl ions - ເຊິ່ງທັງໝົດເກີດຂຶ້ນໃນລະຫວ່າງການເຜົາຜານອາຫານຂອງເຊວ.
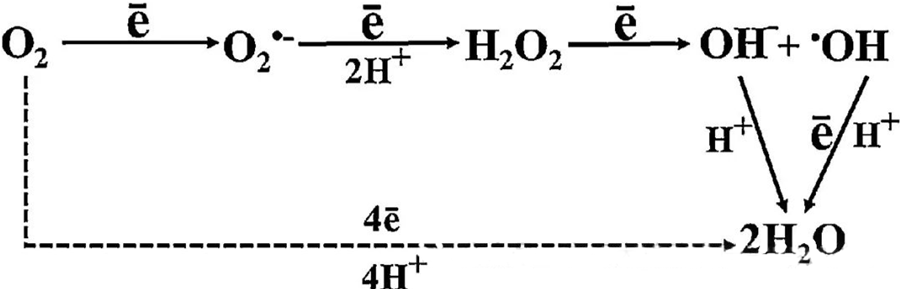
ການພົວພັນລະຫວ່າງ O₂ ແລະ ອົງປະກອບຂອງເຊວແມ່ນມີຄວາມສຳຄັນຫຼາຍໃນການເຂົ້າໃຈວິທີການທີ່ ROS ສ້າງຂຶ້ນພາຍໃນເຊວ. ພາຍໃຕ້ເງື່ອນໄຂສະເພາະໃດໜຶ່ງທີ່ເອີ້ນວ່າຄວາມກົດດັນທາງອົກຊີເດຊັນ, ຄວາມສົມດຸນລະຫວ່າງການສ້າງ ROS ແລະ ການເສື່ອມສະພາບຂອງມັນຈະຖືກລົບກວນ, ເຊິ່ງນຳໄປສູ່ລະດັບ ROS ທີ່ເພີ່ມຂຶ້ນໃນເຊວ. ການຜະລິດ superoxide (O₂⁻) ຖືກກະຕຸ້ນໂດຍ superoxide dismutase, ເຊິ່ງຕໍ່ມາປ່ຽນ O₂⁻ ໄປເປັນ hydrogen peroxide (H₂O₂). ການປ່ຽນແປງນີ້ຖືກຂະຫຍາຍຕື່ມອີກໂດຍປະຕິກິລິຍາ Fenton, ເຊິ່ງອົກຊີເດຊັນ Fe²⁺ ເພື່ອສ້າງອະນຸມູນອິສະລະ hydroxyl (·OH) ແລະ Fe³⁺, ດັ່ງນັ້ນຈຶ່ງເລີ່ມຕົ້ນລໍາດັບ redox ທີ່ເປັນອັນຕະລາຍຂອງການສ້າງ ROS ແລະ ຄວາມເສຍຫາຍຂອງເຊວ.
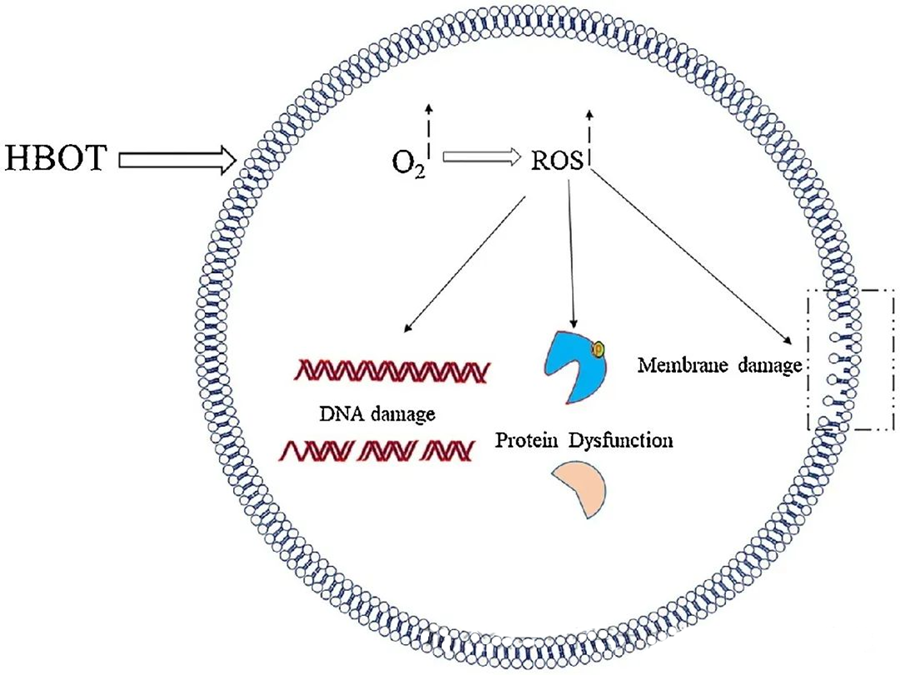
ຜົນກະທົບທີ່ເປັນພິດຂອງ ROS ແມ່ນແນໃສ່ອົງປະກອບຂອງເຊວທີ່ສຳຄັນເຊັ່ນ: DNA, RNA, ໂປຣຕີນ ແລະ ໄຂມັນ. ໂດຍສະເພາະ, DNA ແມ່ນເປົ້າໝາຍຫຼັກຂອງຄວາມເປັນພິດຂອງເຊວທີ່ໄກ່ເກ່ຍໂດຍ H₂O₂, ເພາະມັນລົບກວນໂຄງສ້າງ deoxyribose ແລະ ທຳລາຍອົງປະກອບພື້ນຖານ. ຄວາມເສຍຫາຍທາງດ້ານຮ່າງກາຍທີ່ເກີດຈາກ ROS ຂະຫຍາຍໄປສູ່ໂຄງສ້າງ helix ຂອງ DNA, ເຊິ່ງອາດຈະເປັນຜົນມາຈາກການຜຸພັງຂອງໄຂມັນທີ່ເກີດຈາກ ROS. ສິ່ງນີ້ເນັ້ນໃຫ້ເຫັນເຖິງຜົນສະທ້ອນທີ່ບໍ່ດີຂອງລະດັບ ROS ທີ່ເພີ່ມຂຶ້ນພາຍໃນລະບົບຊີວະພາບ.
ການກະທຳຕ້ານເຊື້ອຈຸລິນຊີຂອງ ROS
ROS ມີບົດບາດສຳຄັນໃນການຍັບຍັ້ງການເຕີບໂຕຂອງຈຸລິນຊີ, ດັ່ງທີ່ສະແດງໃຫ້ເຫັນຜ່ານການສ້າງ ROS ທີ່ກະຕຸ້ນໂດຍ HBOT. ຜົນກະທົບທີ່ເປັນພິດຂອງ ROS ແມ່ນແນໃສ່ສ່ວນປະກອບຂອງຈຸລັງໂດຍກົງເຊັ່ນ: DNA, ໂປຣຕີນ, ແລະ ໄຂມັນ. ຄວາມເຂັ້ມຂຸ້ນສູງຂອງຊະນິດອົກຊີເຈນທີ່ມີການເຄື່ອນໄຫວສາມາດທຳລາຍໄຂມັນໂດຍກົງ, ເຊິ່ງນຳໄປສູ່ການຜຸພັງຂອງໄຂມັນ. ຂະບວນການນີ້ສົ່ງຜົນກະທົບຕໍ່ຄວາມສົມບູນຂອງເຍື່ອຫຸ້ມຈຸລັງ ແລະ ດັ່ງນັ້ນ, ການເຮັດວຽກຂອງຕົວຮັບ ແລະ ໂປຣຕີນທີ່ກ່ຽວຂ້ອງກັບເຍື່ອຫຸ້ມຈຸລັງ.
ນອກຈາກນັ້ນ, ໂປຣຕີນ, ເຊິ່ງເປັນເປົ້າໝາຍໂມເລກຸນທີ່ສຳຄັນຂອງ ROS, ໄດ້ຮັບການດັດແປງອົກຊີເດຊັນສະເພາະຢູ່ໃນສານຕົກຄ້າງຂອງກົດອະມິໂນຕ່າງໆເຊັ່ນ: ຊີສເຕອີນ, ເມທີໂອນີນ, ໄທໂຣຊີນ, ຟີນິລອາລານີນ, ແລະ ທຣິບໂຕແຟນ. ຕົວຢ່າງ, HBOT ໄດ້ສະແດງໃຫ້ເຫັນວ່າກະຕຸ້ນການປ່ຽນແປງອົກຊີເດຊັນໃນໂປຣຕີນຫຼາຍຊະນິດໃນ E. coli, ລວມທັງປັດໄຈການຍືດຕົວ G ແລະ DnaK, ເຊິ່ງສົ່ງຜົນກະທົບຕໍ່ໜ້າທີ່ຂອງຈຸລັງຂອງມັນ.
ເສີມສ້າງພູມຕ້ານທານຜ່ານ HBOT
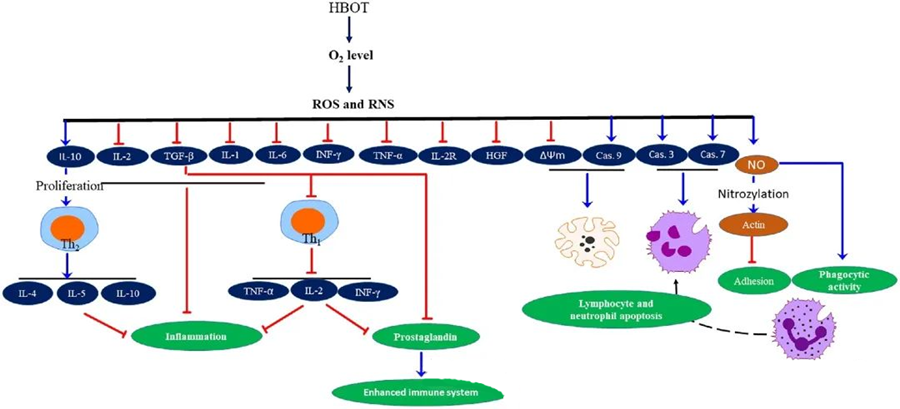
ຄຸນສົມບັດຕ້ານການອັກເສບຂອງ HBOTໄດ້ຖືກບັນທຶກໄວ້, ເຊິ່ງພິສູດໃຫ້ເຫັນວ່າມີຄວາມສຳຄັນຫຼາຍສຳລັບການຫຼຸດຜ່ອນຄວາມເສຍຫາຍຂອງເນື້ອເຍື່ອ ແລະ ສະກັດກັ້ນຄວາມຄືບໜ້າຂອງການຕິດເຊື້ອ. HBOT ມີຜົນກະທົບຢ່າງຫຼວງຫຼາຍຕໍ່ການສະແດງອອກຂອງ cytokines ແລະ ຕົວຄວບຄຸມການອັກເສບອື່ນໆ, ເຊິ່ງມີອິດທິພົນຕໍ່ການຕອບສະໜອງຂອງພູມຕ້ານທານ. ລະບົບການທົດລອງຕ່າງໆໄດ້ສັງເກດເຫັນການປ່ຽນແປງທີ່ແຕກຕ່າງກັນໃນການສະແດງອອກຂອງ gene ແລະ ການສ້າງໂປຣຕີນຫຼັງ HBOT, ເຊິ່ງອາດຈະເພີ່ມ ຫຼື ຫຼຸດປັດໄຈການຈະເລີນເຕີບໂຕ ແລະ cytokines.
ໃນລະຫວ່າງຂະບວນການ HBOT, ລະດັບ O₂ ທີ່ເພີ່ມຂຶ້ນຈະກະຕຸ້ນການຕອບສະໜອງຂອງເຊວຫຼາຍຢ່າງ, ເຊັ່ນ: ການສະກັດກັ້ນການປ່ອຍຕົວກາງທີ່ກະຕຸ້ນການອັກເສບ ແລະ ການສົ່ງເສີມການຕາຍຂອງຈຸລັງລິມໂຟໄຊທ໌ ແລະ ນິວໂທຣຟິວ. ໂດຍລວມແລ້ວ, ການກະທຳເຫຼົ່ານີ້ຊ່ວຍເສີມສ້າງກົນໄກການຕ້ານເຊື້ອຂອງລະບົບພູມຄຸ້ມກັນ, ດັ່ງນັ້ນຈຶ່ງຊ່ວຍໃຫ້ການຮັກສາການຕິດເຊື້ອງ່າຍຂຶ້ນ.
ນອກຈາກນັ້ນ, ການສຶກສາຊີ້ໃຫ້ເຫັນວ່າລະດັບ O₂ ທີ່ເພີ່ມຂຶ້ນໃນລະຫວ່າງ HBOT ສາມາດຫຼຸດຜ່ອນການສະແດງອອກຂອງ cytokines ທີ່ກະຕຸ້ນການອັກເສບ, ລວມທັງ interferon-gamma (IFN-γ), interleukin-1 (IL-1), ແລະ interleukin-6 (IL-6). ການປ່ຽນແປງເຫຼົ່ານີ້ຍັງລວມເຖິງການຫຼຸດອັດຕາສ່ວນຂອງຈຸລັງ T CD4:CD8 ແລະ ການປັບຕົວຮັບທີ່ລະລາຍອື່ນໆ, ໃນທີ່ສຸດກໍ່ເພີ່ມລະດັບ interleukin-10 (IL-10), ເຊິ່ງມີຄວາມສໍາຄັນສໍາລັບການຕ້ານການອັກເສບ ແລະ ສົ່ງເສີມການຮັກສາ.
ກິດຈະກຳຕ້ານເຊື້ອຈຸລິນຊີຂອງ HBOT ແມ່ນກ່ຽວຂ້ອງກັບກົນໄກທາງຊີວະວິທະຍາທີ່ສັບສົນ. ທັງ superoxide ແລະຄວາມກົດດັນທີ່ເພີ່ມຂຶ້ນໄດ້ຖືກລາຍງານວ່າສົ່ງເສີມກິດຈະກຳຕ້ານເຊື້ອແບັກທີເຣຍທີ່ເກີດຈາກ HBOT ແລະ apoptosis ຂອງ neutrophil ທີ່ບໍ່ສອດຄ່ອງກັນ. ຫຼັງຈາກ HBOT, ການເພີ່ມຂຶ້ນຂອງລະດັບອົກຊີເຈນທີ່ເຫັນໄດ້ຊັດເຈນຊ່ວຍເສີມສ້າງຄວາມສາມາດໃນການຂ້າເຊື້ອແບັກທີເຣຍຂອງ neutrophils, ເຊິ່ງເປັນອົງປະກອບທີ່ສຳຄັນຂອງການຕອບສະໜອງຂອງພູມຕ້ານທານ. ນອກຈາກນັ້ນ, HBOT ຍັງສະກັດກັ້ນການຍຶດຕິດຂອງ neutrophil, ເຊິ່ງເກີດຈາກການພົວພັນຂອງ β-integrins ໃນ neutrophils ກັບໂມເລກຸນການຍຶດຕິດລະຫວ່າງຈຸລັງ (ICAM) ໃນຈຸລັງ endothelial. HBOT ຍັບຍັ້ງກິດຈະກຳຂອງ neutrophil β-2 integrin (Mac-1, CD11b/CD18) ຜ່ານຂະບວນການທີ່ໄກ່ເກ່ຍໂດຍ nitric oxide (NO), ເຊິ່ງປະກອບສ່ວນເຂົ້າໃນການເຄື່ອນຍ້າຍຂອງ neutrophils ໄປຫາບ່ອນຕິດເຊື້ອ.
ການຈັດລຽງໂຄງສ້າງຂອງຈຸລັງທີ່ຊັດເຈນແມ່ນມີຄວາມຈຳເປັນສຳລັບ neutrophils ໃນການ phagocytize ເຊື້ອພະຍາດຢ່າງມີປະສິດທິພາບ. S-nitrosylation ຂອງ actin ໄດ້ສະແດງໃຫ້ເຫັນວ່າກະຕຸ້ນການ polymerization ຂອງ actin, ເຊິ່ງອາດຈະອຳນວຍຄວາມສະດວກໃຫ້ແກ່ກິດຈະກຳ phagocytic ຂອງ neutrophils ຫຼັງຈາກການປິ່ນປົວ HBOT ກ່ອນ. ຍິ່ງໄປກວ່ານັ້ນ, HBOT ສົ່ງເສີມ apoptosis ໃນສາຍເຊວ T ຂອງມະນຸດຜ່ານເສັ້ນທາງ mitochondrial, ໂດຍມີການລາຍງານການຕາຍຂອງ lymphocyte ທີ່ເລັ່ງຂຶ້ນຫຼັງຈາກ HBOT. ການສະກັດກັ້ນ caspase-9—ໂດຍບໍ່ມີຜົນກະທົບຕໍ່ caspase-8—ໄດ້ສະແດງໃຫ້ເຫັນເຖິງຜົນກະທົບຂອງ HBOT ໃນການປັບປ່ຽນພູມຕ້ານທານ.
ຜົນກະທົບຮ່ວມກັນຂອງ HBOT ກັບຕົວແທນຕ້ານເຊື້ອຈຸລິນຊີ
ໃນການນຳໃຊ້ທາງດ້ານການຊ່ວຍ, HBOT ມັກຖືກໃຊ້ຄຽງຄູ່ກັບຢາຕ້ານເຊື້ອເພື່ອຕ້ານການຕິດເຊື້ອຢ່າງມີປະສິດທິພາບ. ສະພາບອົກຊີເຈນສູງທີ່ເກີດຂຶ້ນໃນລະຫວ່າງ HBOT ສາມາດມີອິດທິພົນຕໍ່ປະສິດທິພາບຂອງຢາຕ້ານເຊື້ອບາງຊະນິດ. ການຄົ້ນຄວ້າຊີ້ໃຫ້ເຫັນວ່າຢາຂ້າເຊື້ອແບັກທີເຣຍສະເພາະ, ເຊັ່ນ β-lactams, fluoroquinolones, ແລະ aminoglycosides, ບໍ່ພຽງແຕ່ເຮັດວຽກຜ່ານກົນໄກທີ່ມີຢູ່ເທົ່ານັ້ນ ແຕ່ຍັງອາໄສບາງສ່ວນກ່ຽວກັບການເຜົາຜານອາຫານແບບແອໂຣບິກຂອງເຊື້ອແບັກທີເຣຍ. ດັ່ງນັ້ນ, ການມີອົກຊີເຈນ ແລະ ລັກສະນະການເຜົາຜານອາຫານຂອງເຊື້ອພະຍາດແມ່ນມີຄວາມສຳຄັນຫຼາຍເມື່ອປະເມີນຜົນກະທົບດ້ານການປິ່ນປົວຂອງຢາຕ້ານເຊື້ອ.
ຫຼັກຖານທີ່ສຳຄັນໄດ້ສະແດງໃຫ້ເຫັນວ່າລະດັບອົກຊີເຈນຕໍ່າສາມາດເພີ່ມຄວາມຕ້ານທານຂອງ Pseudomonas aeruginosa ຕໍ່ກັບ piperacillin/tazobactam ແລະສະພາບແວດລ້ອມທີ່ມີອົກຊີເຈນຕໍ່າຍັງປະກອບສ່ວນເຮັດໃຫ້ Enterobacter cloacae ຕ້ານທານກັບ azithromycin ເພີ່ມຂຶ້ນ. ໃນທາງກົງກັນຂ້າມ, ສະພາບການຂາດອົກຊີເຈນບາງຢ່າງອາດຈະເພີ່ມຄວາມອ່ອນໄຫວຂອງເຊື້ອແບັກທີເຣຍຕໍ່ກັບຢາຕ້ານເຊື້ອ tetracycline. HBOT ເປັນວິທີການປິ່ນປົວເສີມທີ່ເປັນໄປໄດ້ໂດຍການກະຕຸ້ນການເຜົາຜານອາຫານແບບແອໂຣບິກ ແລະ ການສະໜອງອົກຊີເຈນຄືນໃໝ່ໃຫ້ກັບເນື້ອເຍື່ອທີ່ຕິດເຊື້ອ, ເຊິ່ງຕໍ່ມາເພີ່ມຄວາມອ່ອນໄຫວຂອງເຊື້ອພະຍາດຕໍ່ກັບຢາຕ້ານເຊື້ອ.
ໃນການສຶກສາກ່ອນການທົດລອງທາງຄລີນິກ, ການປະສົມປະສານຂອງ HBOT—ໃຫ້ສອງເທື່ອຕໍ່ມື້ເປັນເວລາ 8 ຊົ່ວໂມງທີ່ 280 kPa—ຄຽງຄູ່ກັບ tobramycin (20 ມກ/ກກ/ມື້) ຫຼຸດຜ່ອນປະລິມານເຊື້ອແບັກທີເຣຍຢ່າງຫຼວງຫຼາຍໃນພະຍາດອັກເສບເຍື່ອຫຸ້ມຫົວໃຈ Staphylococcus aureus. ນີ້ສະແດງໃຫ້ເຫັນເຖິງທ່າແຮງຂອງ HBOT ເປັນການປິ່ນປົວເສີມ. ການສືບສວນຕື່ມອີກໄດ້ເປີດເຜີຍວ່າພາຍໃຕ້ອຸນຫະພູມ 37°C ແລະຄວາມກົດດັນ 3 ATA ເປັນເວລາ 5 ຊົ່ວໂມງ, HBOT ໄດ້ເສີມຂະຫຍາຍຜົນກະທົບຂອງ imipenem ຕໍ່ກັບ Pseudomonas aeruginosa ທີ່ຕິດເຊື້ອ macrophage. ນອກຈາກນັ້ນ, ຮູບແບບການປະສົມປະສານຂອງ HBOT ກັບ cephazolin ພົບວ່າມີປະສິດທິພາບຫຼາຍກວ່າໃນການປິ່ນປົວພະຍາດອັກເສບກະດູກ Staphylococcus aureus ໃນສັດທົດລອງເມື່ອທຽບກັບ cephazolin ດຽວໆ.
HBOT ຍັງເພີ່ມປະສິດທິພາບການຂ້າເຊື້ອແບັກທີເຣຍຂອງ ciprofloxacin ຕໍ່ກັບ biofilms ຂອງ Pseudomonas aeruginosa ຢ່າງຫຼວງຫຼາຍ, ໂດຍສະເພາະຫຼັງຈາກການສຳຜັດກັບເຊື້ອແບັກທີເຣຍ 90 ນາທີ. ການເພີ່ມຂື້ນນີ້ແມ່ນຍ້ອນການສ້າງຊະນິດອົກຊີເຈນທີ່ມີປະຕິກິລິຍາພາຍໃນ (ROS) ແລະສະແດງຄວາມອ່ອນໄຫວທີ່ເພີ່ມຂຶ້ນໃນ mutants ທີ່ມີຄວາມບົກຜ່ອງຂອງ peroxidase.
ໃນຮູບແບບຂອງການອັກເສບເຍື່ອຫຸ້ມປອດທີ່ເກີດຈາກ Staphylococcus aureus (MRSA) ທີ່ທົນທານຕໍ່ methicillin, ຜົນກະທົບຮ່ວມກັນຂອງ vancomycin, teicoplanin, ແລະ linezolid ກັບ HBOT ສະແດງໃຫ້ເຫັນປະສິດທິພາບທີ່ເພີ່ມຂຶ້ນຢ່າງຫຼວງຫຼາຍຕໍ່ກັບ MRSA. Metronidazole, ຢາຕ້ານເຊື້ອທີ່ໃຊ້ຢ່າງກວ້າງຂວາງໃນການປິ່ນປົວການຕິດເຊື້ອ anaerobic ແລະ polymicrobial ຮຸນແຮງເຊັ່ນ: ການຕິດເຊື້ອຕີນເບົາຫວານ (DFIs) ແລະ ການຕິດເຊື້ອບໍລິເວນຜ່າຕັດ (SSIs), ໄດ້ສະແດງໃຫ້ເຫັນປະສິດທິພາບຕ້ານເຊື້ອຈຸລິນຊີທີ່ສູງຂຶ້ນພາຍໃຕ້ເງື່ອນໄຂ anaerobic. ການສຶກສາໃນອະນາຄົດແມ່ນມີຄວາມຈຳເປັນເພື່ອຄົ້ນຫາຜົນກະທົບຮ່ວມກັນຂອງເຊື້ອແບັກທີເຣຍຂອງ HBOT ລວມກັບ metronidazole ທັງໃນ vivo ແລະ ໃນ vitro.
ປະສິດທິພາບຕ້ານເຊື້ອຈຸລິນຊີຂອງ HBOT ຕໍ່ເຊື້ອແບັກທີເຣັຍທີ່ຕ້ານທານ
ດ້ວຍວິວັດທະນາການ ແລະ ການແຜ່ລະບາດຂອງເຊື້ອແບັກທີເຣັຍທີ່ດື້ຢາ, ຢາຕ້ານເຊື້ອແບບດັ້ງເດີມມັກຈະສູນເສຍປະສິດທິພາບຂອງມັນໄປຕາມການເວລາ. ນອກຈາກນັ້ນ, HBOT ອາດຈະພິສູດໃຫ້ເຫັນວ່າມີຄວາມຈຳເປັນໃນການປິ່ນປົວ ແລະ ປ້ອງກັນການຕິດເຊື້ອທີ່ເກີດຈາກເຊື້ອພະຍາດທີ່ດື້ຢາຫຼາຍຊະນິດ, ເຊິ່ງເປັນຍຸດທະສາດທີ່ສຳຄັນເມື່ອການປິ່ນປົວດ້ວຍຢາຕ້ານເຊື້ອລົ້ມເຫຼວ. ການສຶກສາຈຳນວນຫຼາຍໄດ້ລາຍງານຜົນກະທົບທີ່ສຳຄັນຂອງການຂ້າເຊື້ອແບັກທີເຣັຍຂອງ HBOT ຕໍ່ເຊື້ອແບັກທີເຣັຍທີ່ດື້ຢາທີ່ກ່ຽວຂ້ອງທາງດ້ານຄລີນິກ. ຕົວຢ່າງ, ກອງປະຊຸມ HBOT 90 ນາທີທີ່ 2 ATM ໄດ້ຫຼຸດຜ່ອນການເຕີບໂຕຂອງ MRSA ຢ່າງຫຼວງຫຼາຍ. ນອກຈາກນັ້ນ, ໃນຮູບແບບອັດຕາສ່ວນ, HBOT ໄດ້ເສີມຂະຫຍາຍຜົນກະທົບຕ້ານເຊື້ອແບັກທີເຣັຍຂອງຢາຕ້ານເຊື້ອຕ່າງໆຕໍ່ກັບການຕິດເຊື້ອ MRSA. ບົດລາຍງານໄດ້ຢືນຢັນວ່າ HBOT ມີປະສິດທິພາບໃນການປິ່ນປົວໂຣກກະດູກອັກເສບທີ່ເກີດຈາກ Klebsiella pneumoniae ທີ່ຜະລິດ OXA-48 ໂດຍບໍ່ຈຳເປັນຕ້ອງໃຊ້ຢາຕ້ານເຊື້ອເສີມໃດໆ.
ສະຫຼຸບແລ້ວ, ການປິ່ນປົວດ້ວຍອົກຊີເຈນທີ່ມີຄວາມກົດດັນສູງ (hyperbaric oxygen therapy) ເປັນຕົວແທນຂອງວິທີການຫຼາຍດ້ານໃນການຄວບຄຸມການຕິດເຊື້ອ, ເສີມຂະຫຍາຍການຕອບສະໜອງຂອງພູມຕ້ານທານ ພ້ອມທັງເພີ່ມປະສິດທິພາບຂອງຢາຕ້ານເຊື້ອທີ່ມີຢູ່. ດ້ວຍການຄົ້ນຄວ້າ ແລະ ການພັດທະນາທີ່ຄົບຖ້ວນ, ມັນມີທ່າແຮງທີ່ຈະຫຼຸດຜ່ອນຜົນກະທົບຂອງການຕ້ານທານຢາຕ້ານເຊື້ອ, ເຊິ່ງສະເໜີຄວາມຫວັງໃນການຕໍ່ສູ້ຢ່າງຕໍ່ເນື່ອງຕໍ່ກັບການຕິດເຊື້ອແບັກທີເຣຍ.
ເວລາໂພສ: ກຸມພາ-28-2025

